Menu blogs
5. Nicotine, cancer et addiction. Molécule du mois sur la PDB. ->>
<<- 3. Liaisons chimiques : A. Liaisons covalentes (MAO-A et rhodopsine)
4. Liaisons chimiques : B. Liaisons non covalentes (LSD/5HT2B).
21 mai 2022 à 17:02
Pré-requis : Ce billet de blog est la suite du billet 3. Liaisons chimiques : A. Liaisons covalentes (MAO-A et rhodopsine). Pour bien comprendre les visualisations présentées ici, je vous recommande aussi de lire mon 1er billet de blog 1. La tête dans un site actif : Le LSD couplé à son récepteur 5HT2B.
Après avoir découvert les ligands irréversibles (qui sont l’exception), nous allons voir comment la majorité des ligands interagissent avec leurs cibles par différents types de liaisons de faible énergie. On va reprendre la structure du LSD couplé à son récepteur sérotoninergique le 5HT2B pour présenter les interactions. Cette structure est disponible pour tous sur la banque de données de structures expérimentales ici (https://www.rcsb.org/structure/5tvn) sous le code 5TVN. (Pour les confirmés, j’ai retraité la structure expérimentale en supprimant les parties non humaines et en ajoutant les parties non résolues, en créant un modèle par homologie pour avoir uniquement la structure du 5HT2B humain).
Les liaisons non-covalentes
Les liaisons non-covalentes sont typiquement de faible énergie (entre 5kJ et 50 kJ/mol), là où les liaisons covalentes comme la liaison C-C fait environ 350 kJ/mol. Contrairement aux liaisons covalentes, il n’y a pas de partage d’électron dans ce type de liaison. Elles ont pour principales caractéristiques d'être peu stables et facilement brisées, à durée de vie courte, contrairement aux interactions covalentes (encore une fois énergie et stabilité sont corrélées). Cela permet à un neurotransmetteur de se lier à son récepteur par exemple, puis de se déloger une fois que le message chimique a été transmis. Pour simplifier, on peut classer les interactions non-covalentes en 2 catégories :
1. Les interactions reposant sur la force électrostatique. Il existe plusieurs sous-types d’interactions dans cette catégorie :
1.1. Les liaisons ioniques ou c’est la charge nette négative (-1) d’un atome qui va attirer une charge nette positive (+1) d’un autre atome.
1.2. Les liaisons hydrogènes, ou c’est la charge partielle positive (δ+) d’un atome qui va attirer une charge partielle négative (δ-) d’un autre atome (dans les molécules polaires).
1.3. Les liaisons de Van Der Walls ou c’est le mouvement naturel des électrons d’un atome (chargés négativement) qui vont polariser une partie de celui-ci et en retour polariser et attirer un second atome.
1.4. Les liaisons impliquant des cycles aromatiques
2. Les interactions hydrophobiques qui sont bien particulière.
1. Les liaisons électrostatiques
Les liaisons électrostatiques découlent de la loi de Coulomb qui décrit comment 2 particules chargées s’attirent où se repoussent. Si les charges en question sont opposées, elles s’attirent. Si les charges sont de même signe, elles se repoussent. Une bonne analogie est celle de l’attraction ou répulsion entre deux aimants. L’intensité de la force étant bien sûr en fonction de la distance qui les séparent.
Cette notion de charge et d’attirance est capitale pour comprendre l’attraction et la répulsion au niveau atomique. Pour simplifier, dès qu’il y a une différence de charge entre 2 particules, cette force d’attraction sera présente. De cette force découlent 3 principaux types de liaisons reposant sur le même mécanisme, mais pour des conditions différentes : les liaisons ioniques, les liaisons hydrogènes et les interactions de Van Der Walls.
1.1. Les liaisons ioniques
Les liaisons ioniques se produisent lorsqu’un atome ayant une charge nette (+1) rencontre un autre atome ayant une charge nette (-1). On les appelle aussi des ponts salins. Pourquoi ? Parce que c’est cette interaction qui se produit chez les sels, comme par exemple le sel de table NaCl [Na(+)-Cl(-)], mais aussi toutes les formes salines de vos composés préférés [Cocaïne(+)-Cl(-), pour la cocaïne hydrochloride].
Contrairement à la liaison covalente qui arrive lorsque 2 atomes partagent de façon plus ou moins équitable 2 électrons (lorsque leur électronégativité est similaire), la liaison ionique, c’est lorsqu’un atome a totalement accaparé l’électron d’un autre atome.
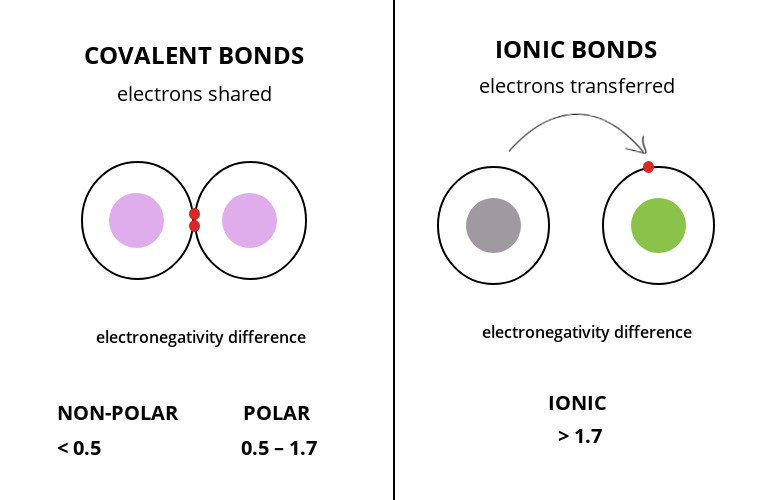
Parmi les liaisons de faibles énergies, cette interaction est assez forte et commence à s’exercer à longue distance. Cette propriété est d’ailleurs potentiellement utilisée par les GPCRs pour attirer les ligands vers le récepteur. Ces récepteurs présentent souvent des acides aminés chargés négativement (glutamate ou aspartate) dans la partie haute du récepteur. Lorsque le ligand (chargé positivement dans le cas du LSD) arrive à proximité, il peut être attiré par cette interaction à longue distance. Ci-dessous un gif du récepteur vu de dessus, avec le LSD en gris, le récepteur en vert avec les aspartates et glutamates chargés négativement.
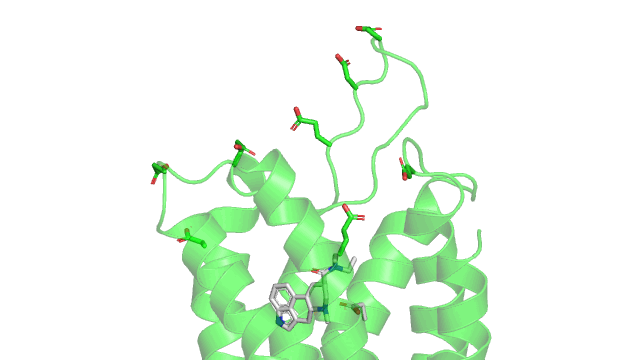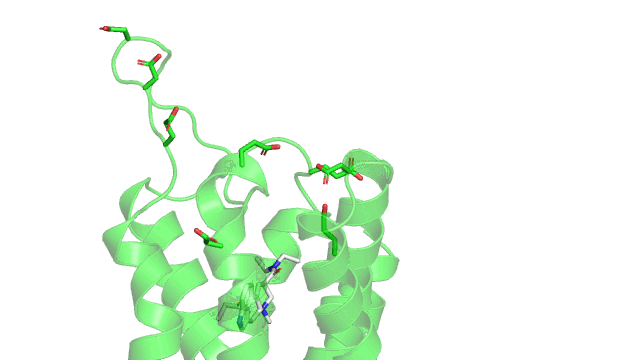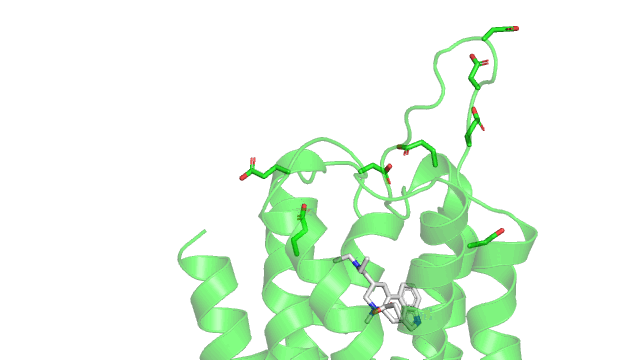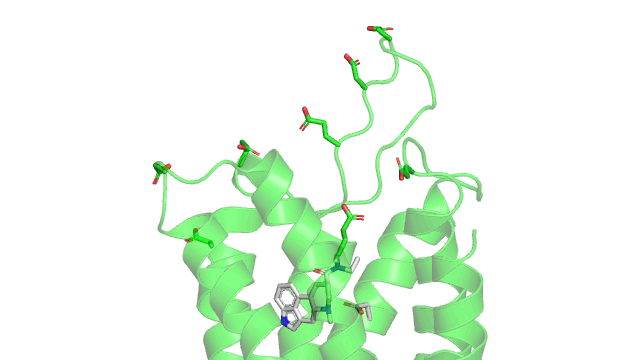
Maintenant voici un gif de la liaison ionique (pointillés rouge) entre le LSD (en gris) et le 5HT2B (en vert) dans son site actif. Sur le gif n’est affiché que les résidus à une distance de moins de 5Å (1 Å ou angstrom équivalent à 10 puissance -10 mètres) du LSD, pour qu’on puisse voir le site actif sans surcharger la figure. Comme précisé précédemment, la liaison ionique se produit entre un aspartate chargé négativement (acide aminé numéro 135 dans la séquence du récepteur, coloré en gris) et l’azote du groupement amine du LSD qui est chargé positivement.
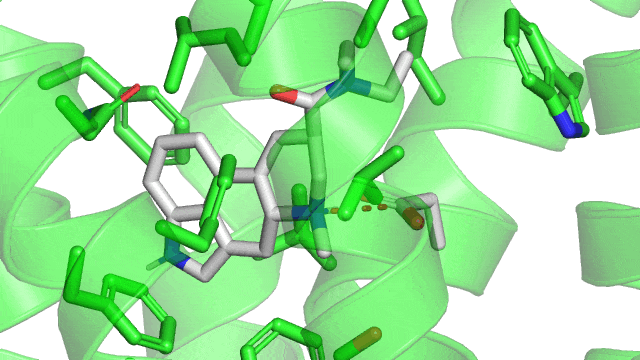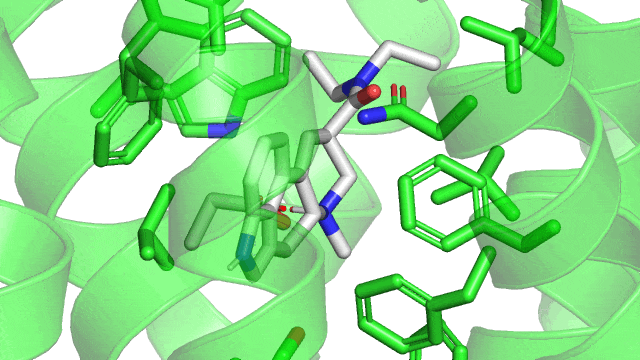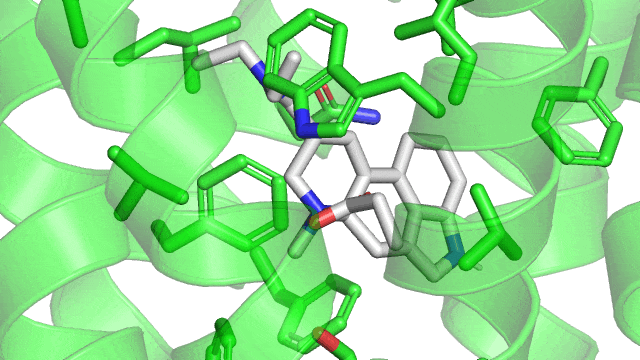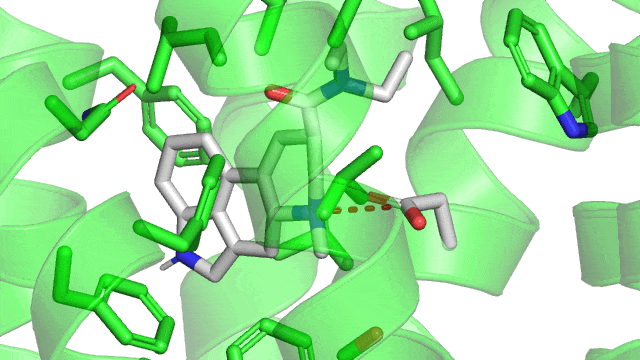
1.2. Les liaisons hydrogènes
Les liaisons hydrogènes peuvent être comparées à des liaisons ioniques, mais au lieu d’avoir des charges pleines (+1 attire -1), cela se passe entre charges dites « partielles ». En effet, comme dit précédemment, suivant l’électronégativité de vos atomes dans une molécule, les électrons des liaisons covalentes vont être attirées vers l’atome ayant une électronégativité plus forte. Comme l’attirance est partielle (sinon ça serait une liaison ionique), alors un atome va avoir une charge partielle positive tandis que l’autre va avoir une charge partielle négative.
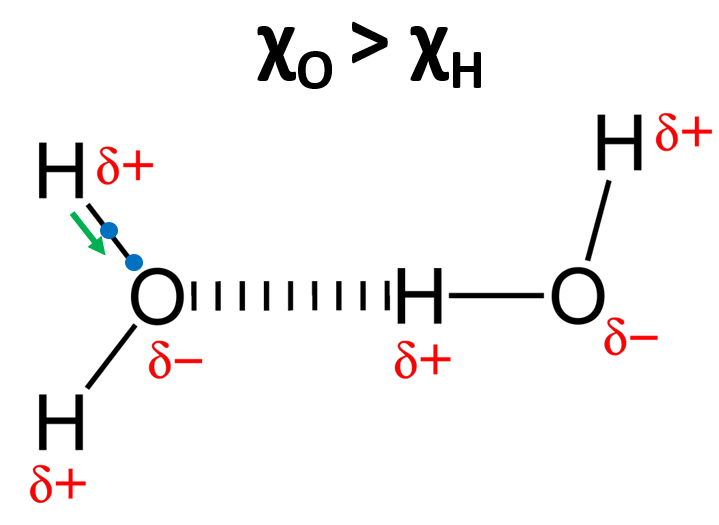
L’exemple le plus parlant est celui de l’eau. Nous avons l’atome d’oxygène qui est plus électronégatif que l’atome d’hydrogène (χO > χH). L’atome d’oxygène attire alors à lui l’électron (représenté en bleu) de l’hydrogène impliqué dans la liaison covalente H-O. Il perd donc un peu de la charge -1 de son électron, il obtient donc finalement une charge partielle positive, tandis que l’oxygène gagne une charge partielle négative. D’après la loi de coulomb vu précédemment, une charge partielle (+) est attirée par une charge partielle (-). Il se crée donc une liaison hydrogène entre l’atome d’oxygène de la première molécule d’eau, avec un atome d’hydrogène de la seconde molécule d’eau. On appelle l’atome d’oxygène de la molécule d’eau de gauche un atome receveur d’hydrogène, et l’atome d’oxygène de la molécule d’eau de droite un atome donneur d’hydrogène. Dans la molécule d’eau, l’atome d’oxygène peut être à la fois receveur 2 fois et donneur 2 fois, mais c’est un cas particulier qui n’est pas toujours retrouvé dans d’autres molécules. Cette capacité à former plusieurs liaisons hydrogènes par molécule d’eau donne ses propriétés unique à ce solvant, je suis sûr que ça doit vous rappeler quelque chose de vos cours du Lycée. La force des liaisons hydrogènes varie suivant les atomes impliqués, mais elle est comprise entre 5 et 30 kJ/mol environ.
Revenons à notre structure du LSD couplé à son récepteur 5HT2B : On observe la présence d’une liaison hydrogène (représentée en pointillées jaunes) entre l’atome d’azote sur le cycle à 5 carbones du LSD (qui va être l’atome donneur d’hydrogène) et la glycine 221 du 5HT2B par l’atome d’oxygène en double liaison avec un carbone (qui va être l’atome receveur). On remarque que le LSD est orienté dans son site actif par la liaison ionique d’un côté, la liaison hydrogène de l’autre.
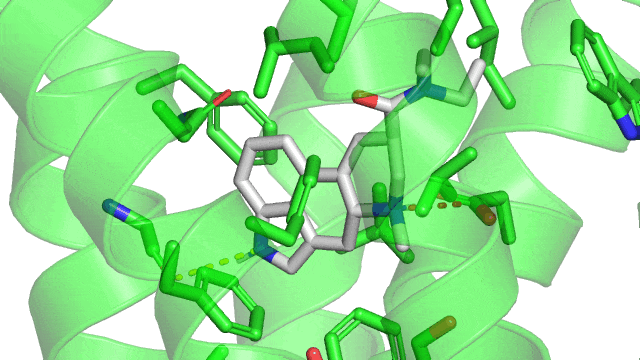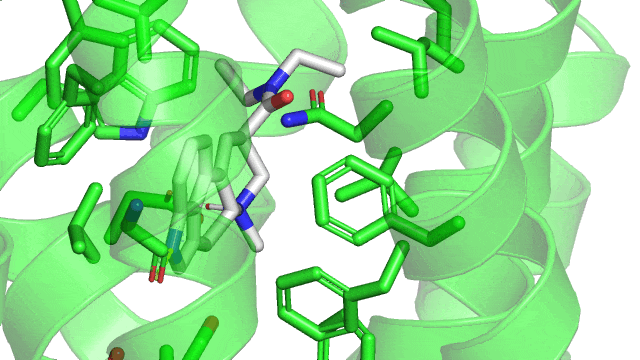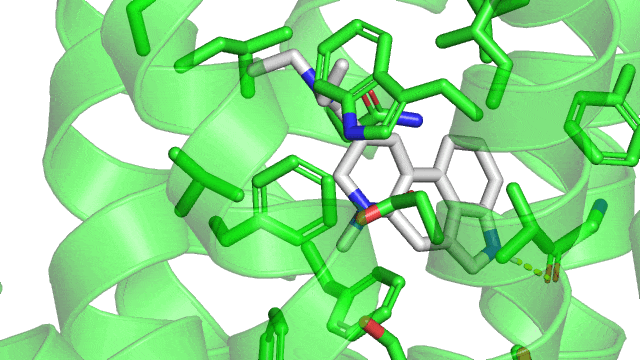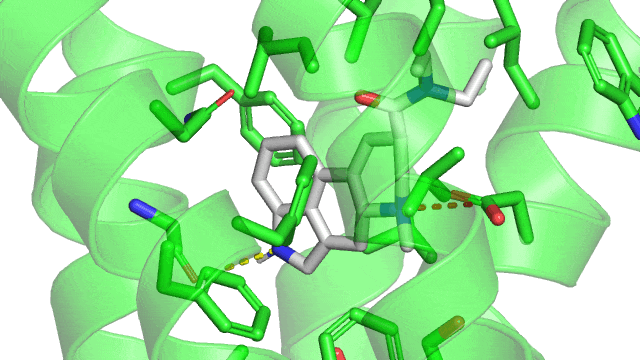
1.3. Les liaisons de van der Walls
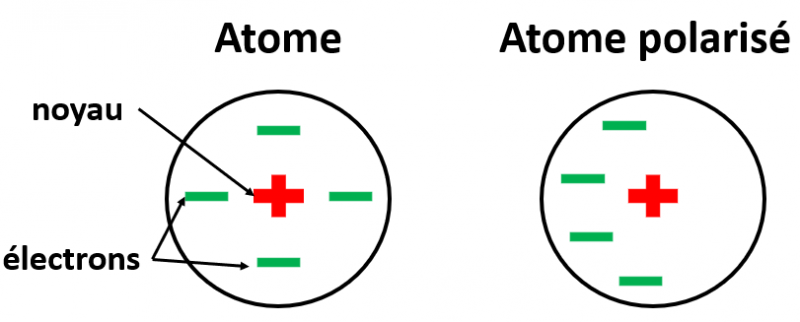
Il existe un dernier type de liaison électrostatique. Ce type de liaison se produit dans toutes les molécules, qu’elles soient polaires (molécules ayant des atomes avec une électronégativité différente) ou apolaires (molécules avec des atomes ayant une électronégativité similaire ou identique). Cependant, elle domine dans le cas d’interaction entre molécules apolaires. C’est encore une fois une différence de charge qui en est la cause, cependant, c’est au niveau atomique que cela se passe (et non pas au niveau d’une molécule comme dans le cas d’une liaison hydrogène).
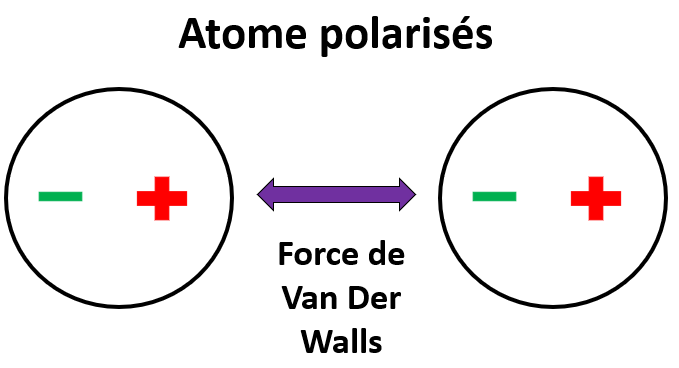
Un atome, c’est simplement un noyau chargé positivement autour duquel gravite des électrons chargés négativement. Comme les électrons bougent en permanence, il arrive que l’atome soit polarisé de lui-même pendant un court laps de temps. C’est-à-dire que d’un côté de l’atome sera chargé plutôt positivement, l’autre plutôt négativement.
Si à ce moment, cet atome polarisé rencontre un autre atome, sa différence de charge va entrainer une différence de charge dans l’autre atome, et ils vont s’attirer. C’est la force de Van Der Walls. Je ne peux pas vous la montrer sur l’image, car elle est en fait présente à chaque atome du LSD qui est en contact avec le site actif du récepteur.
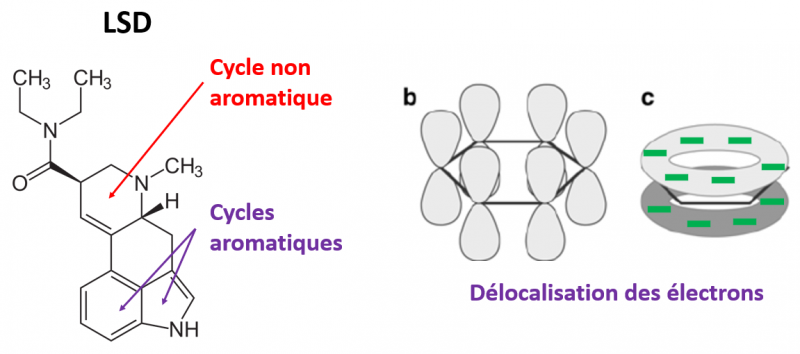
1.4. Les liaisons impliquant des cycles aromatiques
Ici, c’est encore une fois tout simplement une question de charge partielles qui s’attirent, mais dans le cas des molécules aromatiques. Une molécule aromatique, c’est une molécule qui a un groupement cyclique avec des doubles liaisons une liaison sur 2. Le LSD possède 2 cycles aromatiques. Cet agencement spécial des doubles liaisons rend le cycle rigide et produit un nuage électronique particulier (en bouée).
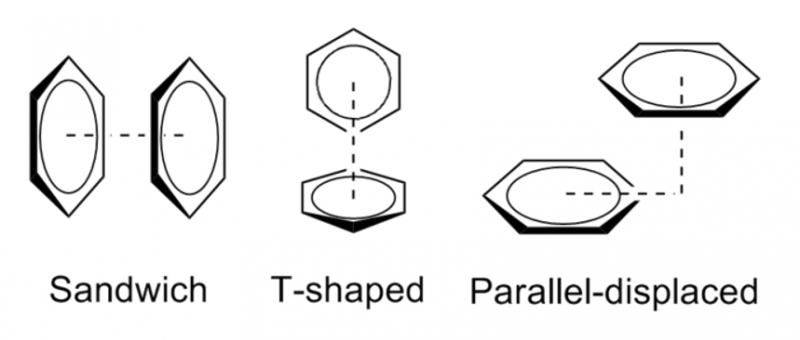
Cette particularité rend possible différentes géométries d’interactions que voici (à noter que la géométrie en sandwich est défavorable car on a collé l’une contre l’autre deux « bouées » chargées négativement):
Dans le cas du LSD couplé à son récepteur le 5HT2B, on observe une jolie interaction T-shaped en pointillés orange, et une interaction parallel-displaced en bleue.
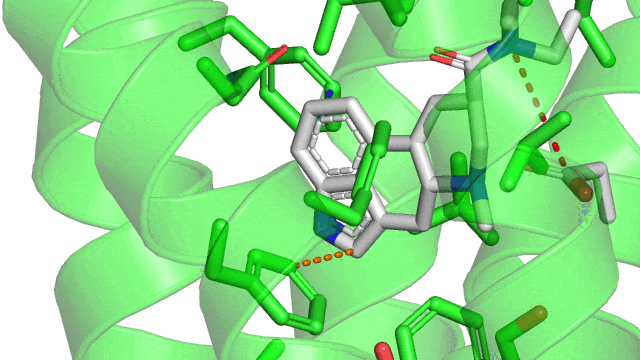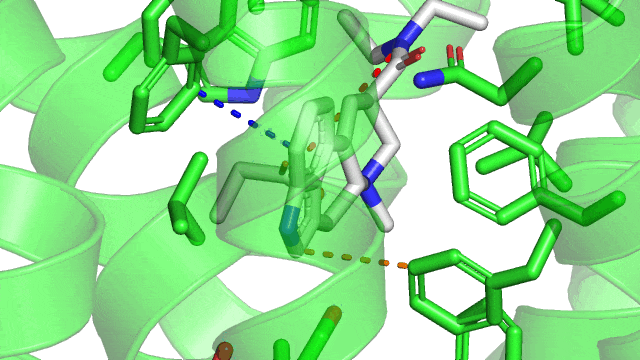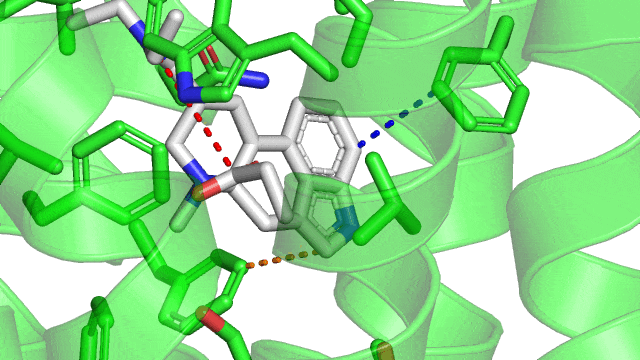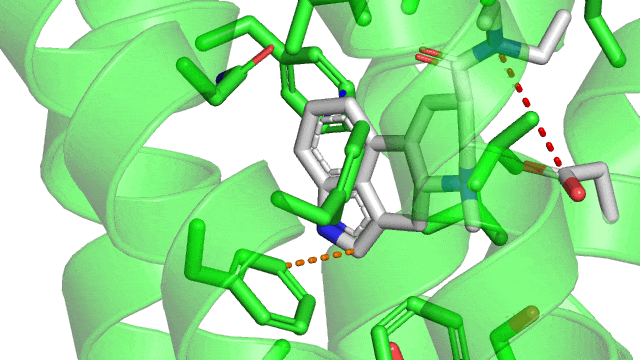
2. Les liaisons hydrophobes
Les liaisons hydrophobes sont d’un tout autre type que les liaisons basées sur l’électrostatiques vues précédemment. On a déduit l’existence de ces interactions en observant la propension que les molécules apolaires ont de s’associer entre elles. Par molécule apolaires, ce sont par exemple les molécules lipidiques qui forment les membranes des cellules, ou tout simplement l’huile ou l’essence qui s’assemble en gouttelettes à la surface de l’eau.
Les liaisons hydrophobes seraient en fait indirectement provoquées par le réseau d’interaction de liaisons hydrogènes qui serait perturbé la présence de ces molécules hydrophobes. Comme les processus thermodynamiques suivent le chemin de moindre résistance, il est plus favorable que les molécules d’eau s’associent entre elles plutôt qu’avec ces molécules hydrophobes. Les molécules hydrophobes fuient alors le milieu et s'associent entre-elles.
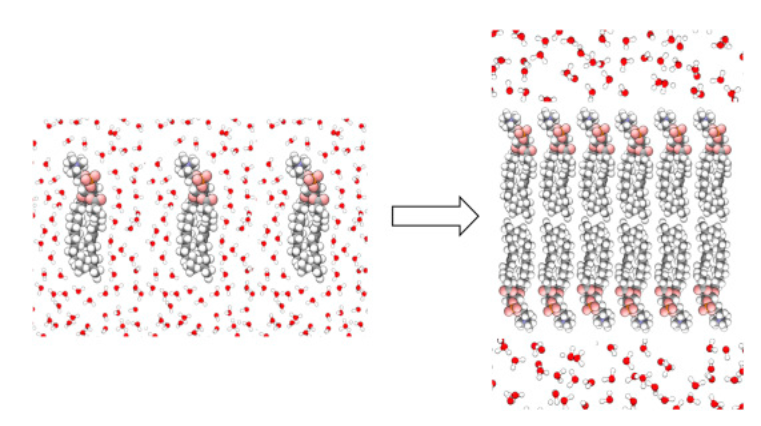
Sur l’image si dessus, on peut voir 3 molécules de lipides entourées de molécules d’eau. Cet agencement n’est pas favorable, car ces trois molécules ne créent pas de liaison hydrogènes avec l’eau et empêchent ainsi les molécules d’eau de maximiser leur réseau d’interaction. Les molécules de lipides sont alors repoussées, jusqu’à former par exemple une bicouche lipidique comme dans l’image de droite, ou d'autres structures comme des miscelles. Les molécules d’eau sont alors totalement libres d’avoir un maximum d’interaction entre elles. On peut dire que les interactions hydrophobes viennent donc d'une force indirecte contrairement aux interactions basées sur la force électrostatique.
Pour le cas de notre LSD avec son récepteur, le LSD possède des parties qui sont capables de former des liaisons hydrogènes comme on a pu le voir. Cependant, cela reste globalement une molécule hydrophobe. Il est donc plus favorable pour lui d’entrer dans le site actif du récepteur et d’entrer en contact avec les acides aminés hydrophobes enfouis dans le récepteur. Il faut cependant noter qu'il existe un cout énergétique pour que le LSD passe d'un état entouré de molécules d'eau, à un état dans le récepteur, mais on y reviendra.
Voilà, vous avez une vague idées des principales interactions qui se produisent entre un ligand et son récepteur. Avec ces bases, je vais pouvoir passer à des billets surement un peu plus sexy et intéressants. Merci de m'avoir lu et n'hésitez surtout pas à me balancer vos commentaires et vos questions.
Si vous ne les avez pas déjà lus, mes autres billets sont ici :
1. La tête dans un site actif : Le LSD couplé à son récepteur 5HT2
2. Prédire la cardiotoxicité d'un RC ? RdR par l'IA.
3. Liaisons chimiques : A. Liaisons covalentes (MAO-A et rhodopsine)

- g-rusalem
Psycho junior - 08 juin 2022 à 21:37
Marco06 a écrit
c quoi ce truc on pige rien wtf ???
Hahaha merci pour ton retour honnête, franc et direct :) Effectivement ce billet est un peu plus théorique et il repose sur les précédents.
Pour simplifier, ce sont les mécanismes qui font qu'une drogue peut fonctionner sur son récepteur. Le LSD te perche, car il arrive à rentrer dans le récepteur sérotoninergique (la porte) d'un neurone comme une clef. Mais ce n'est pas seulement une question de rentrer la clef dans une serrure (le "site actif"). Il faut aussi pouvoir tourner la clef pour activer la porte (le neurone), et c'est par ses interactions "non liantes" (ce que je décris ici, des forces) bien spécifiques que le LSD arrive à le faire. Et t'as plusieurs types de ces forces, comme tu pourrait pousser, tirer, aspirer même si l'analogie n'est pas top.
T'as déjà joué avec 2 aimants qui s'attirent et se repoussent ? Bah une partie de l'action du LSD passe par des forces du même style.
Dit moi si tu piges toujours pas et/ou si tu as d'autres questions, si ça t'intéresse bien-sûr.
Marco06 a écrit
c quoi ce truc on pige rien wtf ???
Je pige pas tout tout mais c'est super intéressant au contraire^^

- g-rusalem
Psycho junior - 10 juin 2022 à 19:04
Merci MG :) La difficulté de l'exercice, c'est qu'il y a différents niveaux de vulgarisation. J'assume le fait d'être plus du côté technique que full vulgarisation, car c'est juste plus intéressant pour moi. Mais je conçois que par exemple sans une base niveau science, c'est hard. Surtout ces 2 billets sur les interactions, mais c'est un pré-requis nécessaire pour la suite. Et je suis plus que content de répondre à n'importe quelles questions, en fait c'est un cadeau que vous me faites à chaque fois, car on apprend vraiment bien en expliquant. Donc n'hésitez surtout pas.
g-rusalem a écrit
1.1. Les liaisons ioniques ou c’est la charge nette négative (-1) d’un atome qui va attirer une charge nette positive (+1) d’un autre atome.
1.2. Les liaisons hydrogènes, ou c’est la charge partielle positive (δ+) d’un atome qui va attirer une charge partielle négative (δ-) d’un autre atome (dans les molécules polaires).
Quelle différence entre charge nette et charge partielle? je veux dire: nette c'est forcément une liaison ionique, et partielle forcément hydrogène?
Du coup ça veut dire comme le nom de la liaison l'indique, que seuls les atomes d'hydrogènes peuvent façonner des liaisons partielles?
Les doubles liaisons des cycles aromatiques, ce sont des liaisons uniquement sur les carbones ou d'autres atomes comptent-ils?
Sur ton image tu montres deux cycles aromatiques. L'un d'eux a un nombre impaire d'atomes: du coup je suppose que l'on considère que même si deux côtés côte à côte n'ont pas de double liaison, ça reste un cycle aromatique c'est bien ça? (en tout cas c'est ce que j'observe).
Pour le cas de notre LSD avec son récepteur, le LSD possède des parties qui sont capables de former des liaisons hydrogènes comme on a pu le voir. Cependant, cela reste globalement une molécule hydrophobe. Il est donc plus favorable pour lui d’entrer dans le site actif du récepteur et d’entrer en contact avec les acides aminés hydrophobes enfouis dans le récepteur. Il faut cependant noter qu'il existe un cout énergétique pour que le LSD passe d'un état entouré de molécules d'eau, à un état dans le récepteur, mais on y reviendra.
Ok, donc le LSD c'est principalement son groupement hydrophobe (diethyl?) qui fait qu'il se lie au récepteur. Et un peu hydrogène et aromatique. Pas de liaison ionique ici?
Et le LSA, qui est je crois plus hydrophile, du coup il se lie moins bien au récepteur ce qui explique sa moindre puissance à doses équivalentes c'est ça? Donc là on a "que" des liaisons aromatiques et hydrogènes?
Xoxo ~

- g-rusalem
Psycho junior - 19 juin 2022 à 10:46
Quelle différence entre charge nette et charge partielle? je veux dire: nette c'est forcément une liaison ionique, et partielle forcément hydrogène?
Du coup ça veut dire comme le nom de la liaison l'indique, que seuls les atomes d'hydrogènes peuvent façonner des liaisons partielles?
Une charge nette, c'est lorsqu'un électron entier est en plus sur un atome (charge -1) ou qu'un électron entier est parti d'un atome (charge +1). Une charge partielle, c'est entre 2 atomes liés par une liaison covalente, lorsqu'un électron de l'atome voisin est attiré (mais pas complètement) vers le premier atome (à cause d'une différente d'électronégativité). Le premier atome va avoir une charge partielle légèrement négative (supérieur à -1 et inférieur à zéro), l'autre une charge partielle légèrement positive (supérieure à zéro et inférieure à 1).
Ici il ne faut pas mélanger une charge partielle et une liaison partielle (tu voulais dire je suppose liaison de faible énergie/liaison non covalente). Les charges partielles créent des effets qui produisent des liaisons de faibles énergies de type polaire, comme les liaisons hydrogènes. Mais les atomes d'hydrogène peuvent aussi provoquer d'autres types de liaisons.
Les doubles liaisons des cycles aromatiques, ce sont des liaisons uniquement sur les carbones ou d'autres atomes comptent-ils?
Ça peut être sur des cycles avec uniquement des carbones comme le benzène, mais il peut y avoir d'autres atomes dans le cycle, comme un azote pour un des cycles du LSD, un oxygène dans le cas du furane par exemple. Il existe une très grande diversité à ce niveau, et tu retrouves beaucoup de cycles aromatiques dans les différentes drogues et composés chimiques du vivant. Ce sont souvent ces cycles qui forment la structure, le squelette de base des médicaments.
Sur ton image tu montres deux cycles aromatiques. L'un d'eux a un nombre impaire d'atomes : du coup je suppose que l'on considère que même si deux côtés côte à côte n'ont pas de double liaison, ça reste un cycle aromatique, c'est bien ça? (en tout cas c'est ce que j'observe).
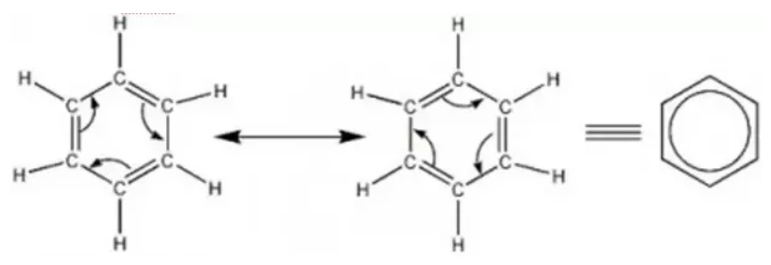
Oui, c'est bien cela. En fait, un cycle aromatique, c'est une structure qui permet le passage d'électrons d'un atome à l'autre en permanence. La structure alterne en permanence entre la première et la seconde structure ci-dessous. Ce passage se fait très rapidement, et c'est pour ça que l'on dit que les électrons des doubles liaisons sont délocalisés (comme mon image au début du post où je parle de structure électronique en "bouée"). Et même parfois on ne se prend pas la tête à écrire les doubles liaisons et on utilise la dernière représentation si dessous pour signifier un cycle aromatique.
Ok, donc le LSD c'est principalement son groupement hydrophobe (diethyl?) qui fait qu'il se lie au récepteur. Et un peu hydrogène et aromatique. Pas de liaison ionique ici?
Et le LSA, qui est je crois plus hydrophile, du coup il se lie moins bien au récepteur ce qui explique sa moindre puissance à doses équivalentes c'est ça? Donc là on a "que" des liaisons aromatiques et hydrogènes?
En fait, je m'aperçois que je n'ai pas ré-affiché une vision d'ensemble de toutes les interactions formées entre le LSD et son site actif. Ça sera plus clair avec. L'affinité du LSD pour le 5HT2B est forte parce qu'il possède tous ces types d'interactions possibles avec le site : liaison hydrogène, liaison ionique, liaisons hydrophobes, liaisons cycle/cycle, et aussi les interactions de Van Der Walls par-dessus lorsque les atomes se touchent. Elles y sont toutes sur le gif suivant, sauf la liaison hydrogène. Mais il ne faut pas oublier que même si je vous montre des images fixes, en réalité il y a à la fois le ligand et le récepteur qui bougent, et des liaisons peuvent être temporairement brisées (et ce même lorsque le ligand est "bloqué" dans son site actif).
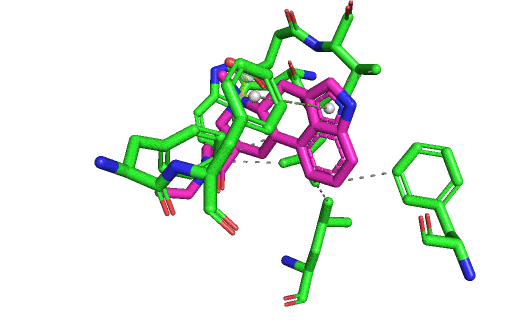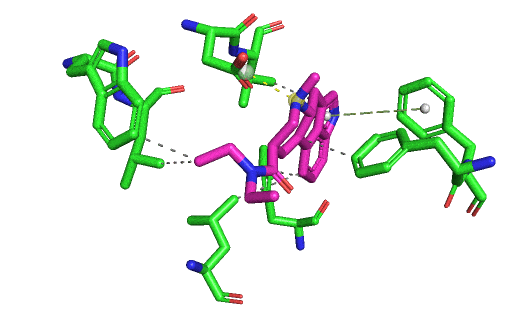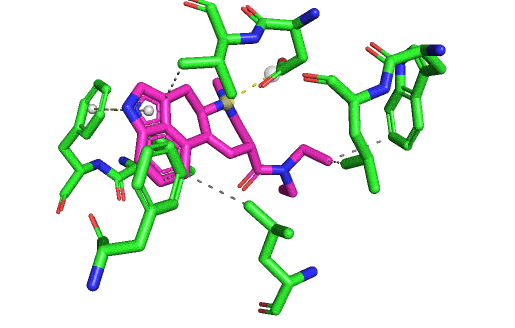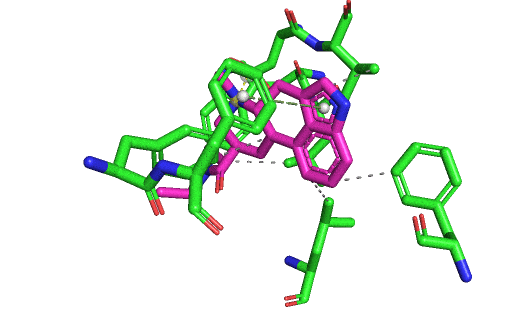
La liaison ionique entre l'aspartate et l'atome d'azote chargé du LSD est capitale, et c'est la marque de fabrique des interactions de tous les récepteurs couplés aux protéines G type "aminergiques". Car il faut absolument une amine chargée aux ligands pour se lier à ce type de récepteurs. Tu peux regarder tous les hallucinogènes, tous les médicaments qui jouent sur les récepteurs à la dopamine, l'adrénaline, la sérotonine, l'histamine. Ils présenteront tous un azote chargé positivement qui va être attiré par la charge négative de l'aspartate en question, présent a la même position dans tous ces récepteurs.
Mis à part ça, je ne sais pas à quel point telle interaction est plus importante qu'une autre. Il existe cependant des techniques informatiques pour obtenir une estimation de l'importance de chaque acide aminé dans l'interaction avec un ligand. On fait une (ou plusieurs) simulations de dynamique moléculaire, pour obtenir une idée de comment bouge le ligand dans son site actif. À partir de là, on peut alors calculer les énergies d'interactions du ligand avec son récepteur et décomposer l'énergie de liaison par acide aminé, avec la technique MM/GBSA.
Je pourrais en parler, mais l'étape suivante, c'est de parler du docking moléculaire, une technique plus simple et plus rapide pour trouver la position d'un ligand dans son site actif et avoir une idée (peu précise) de son énergie d'interaction. D'ailleurs tu m'as donné une idée, je comptais docker le 1P-LSD pour montrer qu'il ne peut pas rentrer dans le site actif et donc que c'est une pro-drug, mais ça sera intéressant de docker aussi le LSA en même temps, qui lui peut rentrer, mais est moins affin. Il faut que je trouve le temps et la motivation, mais donne-moi quelques semaines et je le fais 
Merci encore pour tes questions ! Xoxo 
Affichage Bureau - A propos de Psychoactif - Politique de confidentialité - CGU - Contact - Propulsé par FluxBB -

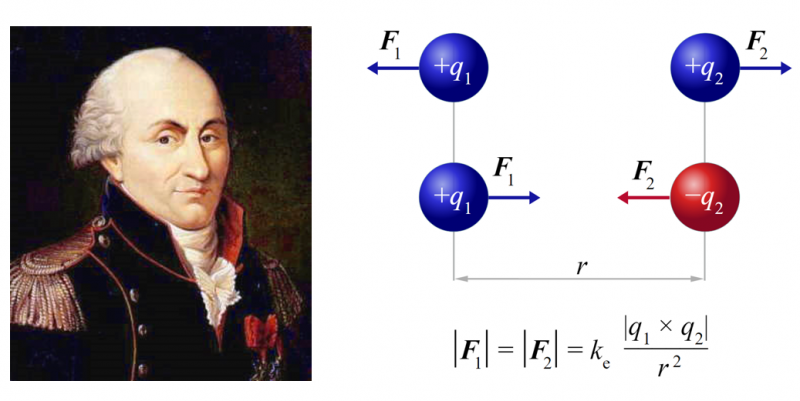
 Soutenez PsychoACTIF
Soutenez PsychoACTIF