Comprendre chimie organique et implications pharmacothérapeutiques
Bon je pointe pas du doigt non plus et c'est pas facile de bien tout saisir dans le domaine des neurosciences mais je pense que quelques bases feraient du bien à tout le monde. Du moins à ceux que ça intéresse. Et puis les réponses à ce genre de post plus haut n'en seront que plus pertinente.
Je remercie par avance ceux qui après ou avant mon thread ci-présent, posait d'abord les questions avant les réponses... disons... vraiment naze.
Dernier point, je peux faire des erreurs je m'en excuse par avance je les corrigerais le plus vite possible au cours de mes relectures.
Chapitre 1 : nomenclature et stéréochimie
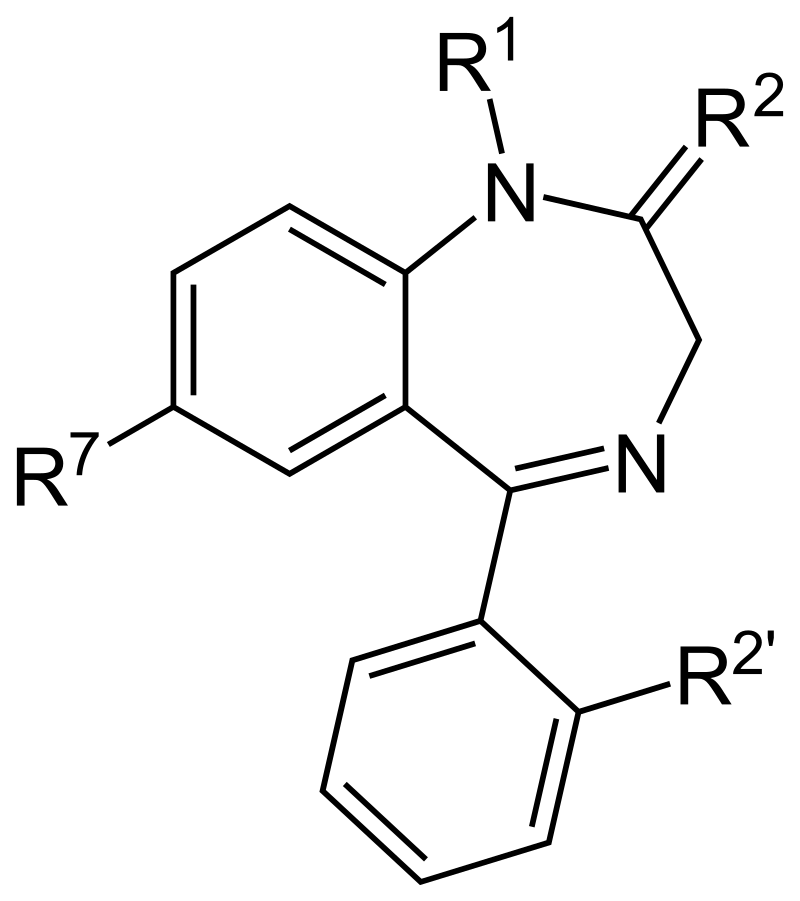
Okay je vais prendre pour exemple l'oxazépam. Son nom moléculaire c'est ça : 7-chloro-3-hydroxy-5-phényl-1,3-dihydro-1,4-benzodiazépine-2-one. C'est sûr que ça donne moins envie d'en prendre pour dormir ahah mais attendez tout va s'éclairer bientôt.
Il faut savoir que la moindre modification entraîne ses conséquences et impactent potentiellement plusieurs facteurs en terme d'effets empiriques sur l'être humain.
C'est parti et on va du côté des benzodizépines. Je prend l'oxazépam car vous pourrez trouver facilement de la documentation la dessus ce qui me sert pour me référencer et appuyer mes propos et puis vous sert vous pour vous y retrouvez (et puis s'assurer que je ne dis pas de la merde).
Déjà de base l'oxazépam est particulier. Son métabolisme n'est pas hépatique ce qui réduit les interactions médicamenteuses. Mais ici on va voir que tel ou tel groupe chimique a tel ou tel effets.

L'halogène en position 7 du cycle A favorise l'activité anxiolytique. La suppression de la double liaison de l'azote en position 4 du cycle B diminue l'activité. Le groupement OH en position 3 du cycle B fait augmenter la polarité de la molécule, favorise la glucuronoconjugaison et une élimination plus rapide.
Une structure dont l'architecture empêche le collapse hydrophobe va permettre une reconnaissance 3D avec la protéine ce qui va augmenter les chances de biodisponibilité pour l'oxazépam.
Bibliographie :
https://pubchem.ncbi.nlm.nih.gov/compound/4616
Dernière modification par Heashka (14 novembre 2019 à 22:38)
Je cours entre l'hôpital, le laboratoire et les services neuropsychiatriques quand je ne suis pas en conférence à la faculté de médecine pour écouter l'actualité sur l'addictologie.
Hors ligne
- Abracabrantesque
Psycho sénior
- 14 novembre 2019 à 20:42
Si j'ai bien compris, tu expliques qu'avec une molécule différente, on a des effets différents? Ou bien quel morceau de la molécule fait quoi? Ou je suis passé à côté de quelque chose?
Dernière modification par Abracabrantesque (14 novembre 2019 à 20:57)
Hors ligne

- Mister No
Pussy time - 14 novembre 2019 à 21:37

Just say no prohibition !
Hors ligne

En effet, mon but est un partage au plus grand monde et je ne vise pas la niche des professionnels de santé que nous sommes

Je cours entre l'hôpital, le laboratoire et les services neuropsychiatriques quand je ne suis pas en conférence à la faculté de médecine pour écouter l'actualité sur l'addictologie.
Hors ligne
On va commencer par les bases, la nomenclature, à savoir le nom qui permet d'identifier chaque molécules.
On est dans le sous-domaine de la biochimie, la nomenclature est un concept d'un enseignement spécifique qu'on nomme la stéréochimie.
C'est dans cette branche qu'on se charge de décrire et représenter les molécules.
Dans l'industrie pharmaceutique et la chimie analytique, il y a plusieurs normes selon les pays ou d'autres facteurs mais on va pas s'atarder la dessus.
Ce qu'il faut retenir, c'est que pour représenter une molécule, on définit la constitution et la configuration.
La constitution d'une entité moléculaire précise la nature et les modes d'union des atomes formant cette entité, en incluant la multiplicité des liaisons sans tenir compte de leur disposition dans l'espace.
La configuration d'une entité moléculaire est la disposition spatiale des atomes ou des groupes d'atomes de cette entité.
Ensuite, on s'intéresse à la chiralité et enfin à l'énantiométrie.
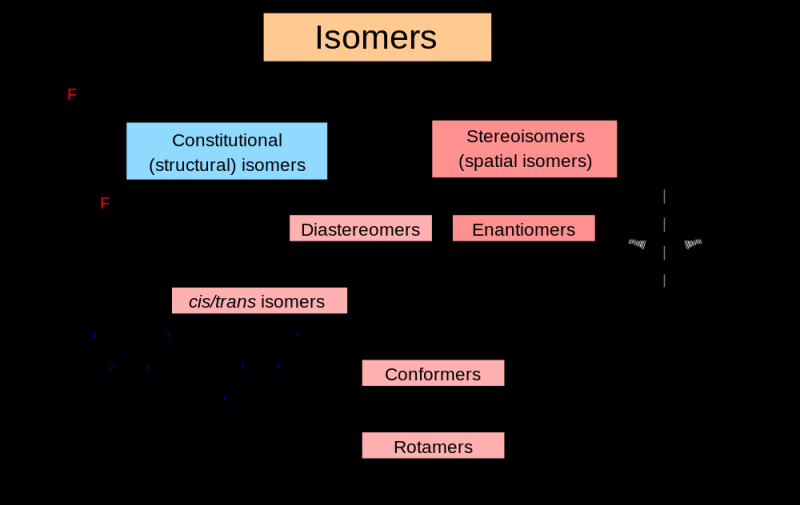
RAPPEL : l'isomère signifie une molécule de formule identique mais structurellement différente (donc de même pour ses propriétés). Il y a deux types isomères, structurelle (constitution) ou spatiale (=configuration stéréo).
Si une molécule est chirale, elle possède au moins deux formes dites énantiomères qui se différencient par une configuration absolue opposée. Il est nécessaire que tous les éléments asymétriques soient opposés entre une molécule et son énantiomère.
Donc conclusion sur ce chapitre avec pour reprendre l'exemple de la kétamine :
La molécule est chirale c'est à dire qu'elle n'est pas superposable à son image dans un miroir plan. Donc deux faces différentes. La formule est bien identique que ce soit une face ou l'autre c'est de la kétamine. Mais structurellement elle est différente et c'est ce qui va expliquer les changements en terme d'effets cliniques.
(Enfin, si on parle de molécule racémique, alors ça veut dire qu'on a un mélange (normalement égal) des deux faces.)
Chapitre 2 : quelques concepts quand on invente une drogue
La réglementation dans l'industrie pharmaceutique est incroyablement sévère et rigoureuse. Que vous soyez vous lecteur autodidacte ou en formation ou en pratique, on ne s'attarde pas forcément très longtemps la dessus mais c'est très intéressant d'assimiler quelques points notamment la pharmacophore.
Qu'est ce que la pharmacophore ?
Quand un laboratoire découvre une drogue, celui-ci va progressivement essayer d'enlever tous les groupes chimiques jusqu'à épurer au maximum la molécule. Le but est de garder la même efficacité et puissante et de réduire tout ce qui est inutile.
Lorsque l'on a découvert les antibiotiques avec la pénicilline, aussi génial que fut la découverte, y avait plein d'inconvénients, alors comment on est arrivé à l'idéal de médicament recherché, comment on a pu inventer une flopée d'antibio, l'amoxicilline, etc.
Eh bien on identifie le pharmacophore. On prend notre molécule de base minimal pour avoir l'effet qu'on souhaite et on ajoute des groupes par ci par là ou on en enlève pour avoir le médicament "parfait".
On parle de pharmacomodulation pour améliorer notre molécule.
La structure permet d'anticiper les effets d'une drogue. Les paramètres théoriques également. Plus une molécule est hydrophobe et liposoluble, plus celle-ci atteindra facilement sa cible par la membrane lipidique qu'elle doit traverser.
Suite à venir... Hésitez pas à me donner vos retours il est un peu tard et je me suis peut être un peu disperser
Dernière modification par Heashka (16 novembre 2019 à 04:22)
Je cours entre l'hôpital, le laboratoire et les services neuropsychiatriques quand je ne suis pas en conférence à la faculté de médecine pour écouter l'actualité sur l'addictologie.
Hors ligne
Abracabrantesque a écrit
Hello H K !
Si j'ai bien compris, tu expliques qu'avec une molécule différente, on a des effets différents? Ou bien quel morceau de la molécule fait quoi? Ou je suis passé à côté de quelque chose?
Ca va même bien plus loin, pour une MEME molécule ! selon sa chiralité (l'un des deux reflet du miroir si tu veux), les effets seront différents (exemple en 2spee : la face D de la meth est psychoactive et la phase L de la meth est un simple décongestionnnt).
Pour le morceau de la molécule, en effet c'est bien ce que je voulais expliquer. Par exemple dans l'industrie pharmaceutique, il est reconnu que dans une grande majorité, mettre un groupe méthyl à un médicament augmente le temps d'action voir l'intensité et la puissance :)
Je cours entre l'hôpital, le laboratoire et les services neuropsychiatriques quand je ne suis pas en conférence à la faculté de médecine pour écouter l'actualité sur l'addictologie.
Hors ligne

- Mister No
Pussy time - 16 novembre 2019 à 08:21
Quand un laboratoire découvre une drogue, celui-ci va progressivement essayer d'enlever tous les groupes chimiques jusqu'à épurer au maximum la molécule.
Puisque tu parles d'épuration.
Pourquoi le polamidon est différent de la méthadone bouchara ?
Levomethadone pour les allemands et soupe au miroir pour les autres ?
Le choix est délibéré, non ?
L'industrie pharma à pris la même option pour le THC que pour la méthadone allemande. Aba pouquoi ?
Ces choix ont forcément des conséquences mais pour le THC, l'échec semble programmé dans l'œuf.
http://www.who.int/medicines/areas/qual … Review.pdf
Ce qui est stupéfiant c'est l'axe de recherche de l'industrie pharma ici :
Chemical Name: (6aR,10aR)-6a,7,8,10a-tetrahydro-6,6,9-trimethyl-3-pentyl-6Hdibenzo[b,d]pyran-1-ol
Qu'une seule molécule soit testée sans aucun autre cannabinoïde, je peux comprendre, la démarche passe par l'étude d'un isomer, un deuxième d'une deuxième molécule à part avant de réunir les deux pour les étudier simultanément.
C'est ce modèle qui freine aussi l'accès au savoir, pour étudier les cannabinoïdes raisonnablement car le modèle actuel demanderait des moyens exponentiel si on devait aller au delà de deux molécules combinées. Ce qui a été réalisé pour THC et CBD.
Ce modèle est incontestable pour moi, mais il va falloir l'adapter. C'est une forme de rigueur fondamentale que je ne conteste pas.
Ajouté à cela qu'ils ont dev un isomer bien plus potent que le plus potent des Delta* THC pris de la manière la plus erratique possible, à l'oral, (Dronabinol) pas étonnant que patients pharmaciens et médecins préfèrent la voie de la vaporisation de différents cultivars permettant de moduler l'action en dehors du dosage. Ce que permet le full spectrum.
La voie digestive en plus va accentuer la lourdeur des métabolites dans le sang. On peut pourtant anticiper cet écueil sans s'écarter de la rigueur nécessaire.
La pilule du coup passé mal, c'est pas un mauvais jeu de mot, la plante est plus efficace qu'un seul isomer.
C'est pour cela que médecins et pharmaciens préfèrent disposer d'un panel de cultivars à vaporiser ou différentes teintures full spectrum pas pasque ce sont des hippies qui idéalisent une plante, parceque c'est nettement plus efficace.
Ce choix d'utiliser l'isomer décrit dans le pdf parait totalement aberrant.
On se croit dans les années 60 ou 70. Retour vers le passé.
Effets erratiques, dosages et absorptions erratiques, biodispo imprévisible... Métabolites différents.
Beaucoup trop de mauvais choix à mon goût.
Based on an alternate monoterpenoid numbering system, ?9-THC is also known as ?1-THC (see: chemical structure above). The pharmacological activity of ?9-THC is stereospecific; the (-)-trans isomer (dronabinol) is 6-100 times more potent than the (+)-trans isomer depending on the assay (Dewey et al., 1984). Preparations of dronabinol can be administered by mouth (oral, sublingual or buccal), as rectal suppositories, pulmonary (smoked, inhaled with a vaporizer, aerosolized or nebulized), intravenously, topically (ophthalmic application), or with transdermal delivery systems (Grotenhermen, 2004). Receptor binding: To date two cannabinoid receptors have been identified, the CB1 (cloned in 1990) (Matsuda et al., 1990), and the CB2 receptor (cloned in 1993) (Munro et al., 1993), exhibiting 48% amino acid sequence identity. Besides their difference in amino acid sequence,
Pourquoi dans ce cas démarrer avec cet isomer à l'oral ?
Merci du partage même si tu vas un peu vite pour moi. 
Dernière modification par Mister No (16 novembre 2019 à 12:38)
Just say no prohibition !
Hors ligne
Sujets similaires dans les forums, psychowiki et QuizzZ
» Comprendre chimie organique et implications pharmacothérapeutiques
Affichage Bureau - A propos de Psychoactif - Politique de confidentialité - CGU - Contact -
 0, 9509 vues, dernier message :
0, 9509 vues, dernier message :  Soutenez PsychoACTIF
Soutenez PsychoACTIF