Menu blogs
7. Les opiacés et la douleur du point de vue atomique (en vidéo). ->>
<<- 5. Nicotine, cancer et addiction. Molécule du mois sur la PDB.
6. Comment l'adrénaline transmet son signal ? (Mol. du mois PDB)
04 juin 2022 à 11:29
Je vous partage aujourd’hui une seconde traduction de « la protéine du mois » sur la PDB (billet en anglais ici), avec une image structurelle magnifique de toute la voie de signalisation qui se déclenche lorsqu’on active un récepteur couplé aux protéines G. En parlant d'image structurelle, je veux dire que chaque protéine impliquée a été résolue par microscopie. Ce n'est pas une image totalement symbolique, toutes les structures ont exactement cette forme en réalité, mis à part bien-sûr le côté dynamique que chacune de ces molécules possèdent.
Si par exemple vous voulez mieux comprendre comment l’adrénaline transmet son message chimique au cœur de la cellule réceptrice, c’est expliqué ci-dessous. C'est exactement le même mécanisme qui se met en place pour la dopamine et les récepteurs dopaminergiques, la sérotonine et les récepteurs sérotoninergiques, ainsi que tous les agonistes de ces récepteurs (l'action des hallucinogènes sur les récepteurs sérotoninergiques par exemple). Cela n'explique pas l'action des molécules agissant sur les transporteurs à la dopamine, adrénaline et sérotonine comme les antidépresseurs ou la MDMA (à venir).
Les protéines G reçoivent les signaux des récepteurs cellulaires et les transmettent à l'intérieur de la cellule.
Les cellules communiquent en se transmettant de petits messages (chimiques) jetables. Certains de ces messagers voyagent vers des parties éloignées du corps par le biais du sang (hormones), d'autres se diffusent simplement vers une cellule voisine (neurotransmetteurs). Ensuite, une autre cellule capte le message et le lit. Des milliers de ces messages sont utilisés dans le corps humain. Parmi les exemples familiers, citons l'adrénaline (petite molécule), qui contrôle le niveau d'excitation, le glucagon (peptide), qui transmet des messages sur le taux de sucre dans le sang, l'histamine (petite molécule), qui signale les lésions tissulaires et la dopamine (petite molécule), qui relaie les messages du système nerveux.
Comment lire le courrier ?
Dans de nombreux cas, ces messagers moléculaires ne pénètrent jamais à l'intérieur des cellules. Au lieu de cela, le message est capté par un récepteur à la surface de la cellule et le signal est ensuite transmis de l'extérieur vers l'intérieur par une chaîne de molécules de signalisation. Les protéines G, telles que celle représentée ici à partir de l'entrée 1gg2 de la PDB, constituent le maillon central de cette chaîne de communication. Le système des protéines G est la méthode de signalisation la plus courante dans nos cellules. Des milliers de récepteurs couplés aux protéines G (RCPG) ont été découverts sur nos cellules, chacun attendant son propre messager particulier. Certains, comme le récepteur du glucagon, reconnaissent les hormones et modifient le niveau du métabolisme. D'autres, comme le récepteur adrénergique, sont utilisés dans le système nerveux pour transmettre les signaux nerveux. Notre sens de la vue repose également sur la rhodopsine (voir ici pour un aperçu de la structure et du fonctionnement du récepteur sur mon billet numéro 3), un récepteur couplé à la protéine G qui est sensible à la lumière. Un millier de formes différentes de ces récepteurs, chacun reconnaissant l'odeur d'une molécule différente, contrôlent notre odorat. Ils ont tous en commun la combinaison d'un récepteur qui reçoit un message et d'une protéine G qui le délivre à l'intérieur de la cellule.
Les récepteurs couplés aux protéines G font partie de la classe des récepteurs métabotropiques. Ils détectent des messagers moléculaires à l’extérieur de la cellule. En changeant de conformation, ils lancent une cascade de signalisation (c'est-à-dire un enchainement des réactions métaboliques) à l’intérieur de la cellule. Cette classe de récepteur est à opposer aux récepteurs ionotropiques (comme le canal ionique des récepteurs nicotiniques décris ici dans mon billet numéro 5) qui, eux, laissent passer des ions lorsqu’ils sont activés par un signal chimique.
Le "G" des protéines G
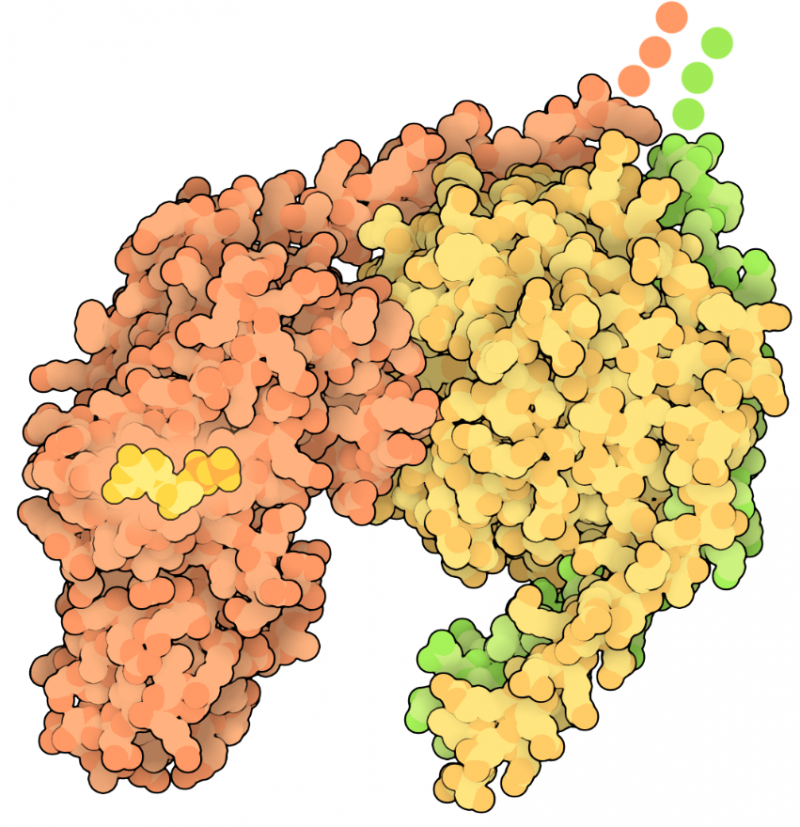
Les protéines G sont des interrupteurs moléculaires qui utilisent le GDP pour contrôler leur cycle de signalisation. Lorsque le GDP est lié, comme illustré ici, la protéine G est inactive. Pour activer la protéine, le GDP est remplacé par du GTP, la protéine G va délivrer son signal, comme illustré ci-dessous. Les protéines G existent sous de nombreuses formes et tailles. La plupart sont utilisées pour la signalisation cellulaire, mais d'autres types jouent un rôle important dans d'autres tâches, comme la synthèse des protéines. Celles décrites ici sont appelées protéines G hétérotrimériques parce qu'elles sont composées de trois chaînes différentes, appelées alpha, bêta et gamma (représentées ici en orange, jaune et vert).
Ces protéines G se fixent à la surface interne de la membrane cellulaire, les maintenant à proximité de leurs récepteurs. Plusieurs petits lipides sont attachés aux chaînes de protéines, qui s'insèrent dans la membrane et y fixent la protéine. Cependant, n'essayez pas de trouver ces petits lipides dans le fichier de la structure cristalline, car ils ont été retirés pour permettre la cristallisation.
La technique de cristallographie aux rayons X est une technique de microscopie très avancée permettant d’obtenir une structure tridimensionnelle avec une résolution extrême (de l’ordre d’un atome). La difficulté majeure de cette technique repose sur la nécessité d’obtenir un cristal de la protéine d’intérêt. Lorsque la protéine d’intérêt est une protéine membranaire, cela rajoute une couche de difficulté. On peut passer des mois ou années pour obtenir un cristal permettant de finalement résoudre la structure d’une protéine. Malgré ces difficultés, à l'heure actuelle, plus de 80% des structures dans la PDB ont été obtenues avec cette technique de microscopie. Il existe cependant une nouvelle technique, la cryomicroscopie électronique qui est en train de prendre de l'ampleur et qui permet de résoudre la structure de protéines qui étaient jusqu'à présent impossibles à résoudre avec la cristallographie.
Les protéines G attaquées
Le système des protéines G joue un rôle central dans de nombreuses tâches de signalisation, ce qui en fait une cible sensible pour les médicaments et les toxines. De nombreux médicaments actuellement sur le marché, comme la Claritine et le Prozac, ainsi qu'un certain nombre de drogues, comme l'héroïne, la cocaïne et la marijuana, agissent au niveau des récepteurs couplés aux protéines G dans ces chaînes de signalisation. La bactérie du choléra fabrique une toxine qui attaque directement les protéines G, en fixant un groupe nucléoside à un endroit stratégique. Cette modification rend la protéine G continuellement active. Entre autres choses, cela perturbe les contrôles normaux de l'équilibre des fluides dans les cellules intestinales, et la personne infectée se déshydrate rapidement en perdant de l'eau, du sodium et du chlorure.
Relayer le signal
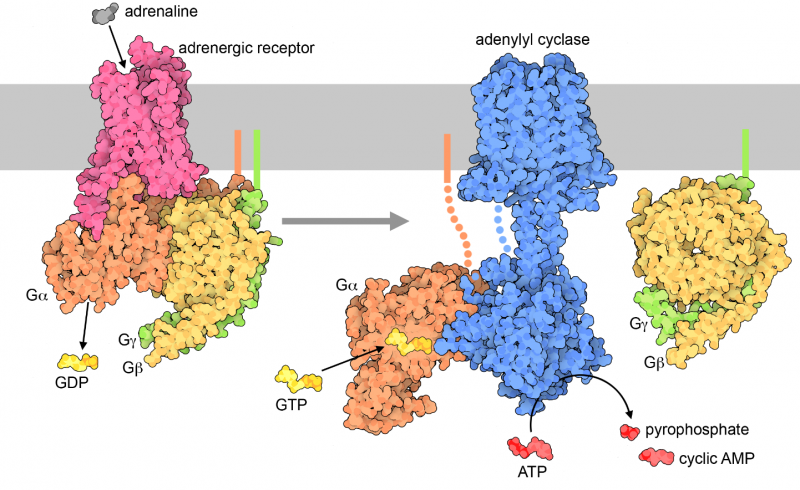
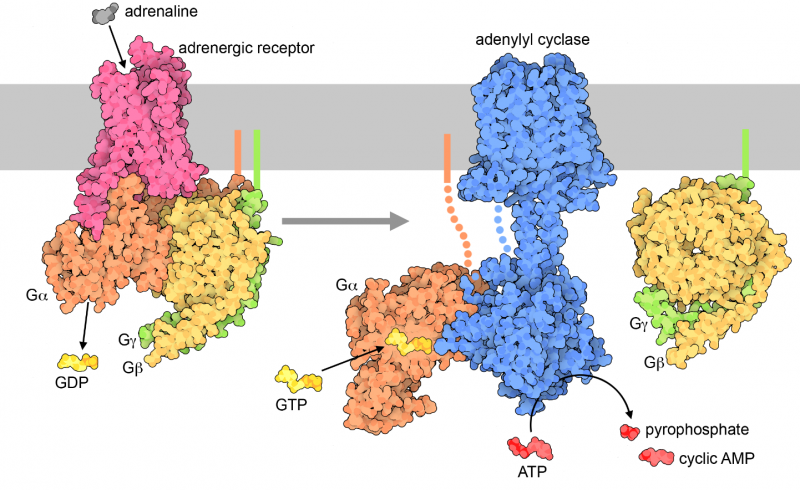
Les protéines G relaient leur signal sur la surface intérieure de la membrane cellulaire. Le processus commence lorsqu'un récepteur se lie à l'hormone ou au neurotransmetteur qui lui est propre, comme l'adrénaline (illustré à gauche par l'entrée 3sn6 de la PDB). La forme du récepteur est alors modifiée et il se lie à la protéine G inactive à trois chaînes située à l'intérieur. Cela amène la protéine G à expulser sa molécule de PIB et à la remplacer par du GTP. Le GTP entraîne un changement de forme d'une petite boucle, et la protéine G tombe en deux morceaux. La sous-unité alpha libérée, avec son GTP lié, se déplace alors le long de la membrane jusqu'à ce qu'elle trouve l'enzyme adénylyl cyclase (comme illustré à droite à partir des entrées PDB 6r3q et 1tbg). La petite boucle se lie alors à l'enzyme et l'active. L'adénylyl cyclase activée produit alors beaucoup d'AMP cyclique, ce qui propage le signal dans la cellule. Finalement, le GTP de la sous-unité alpha active se décompose en GDP, et la protéine G retourne à son état inactif de repos.
L'un des principaux avantages de cette approche est qu'elle permet d'amplifier le signal. Dans la chaîne de signalisation illustrée ici, une seule molécule d'adrénaline peut stimuler la production de nombreuses molécules d'AMP cyclique. En incorporant une enzyme (comme l'adénylyl cyclase) dans la chaîne, un signal faible provenant de l'extérieur de la cellule peut être traduit en un signal fort dans tout l'intérieur de la cellule.
Si on étudie le cas intéressant du sens de l'odorat chez l'insecte et chez les mammifères, on observe que la nature utilise 2 systèmes moléculaires très différents. C'est un peu comme si la nature avait inventée l'olfaction à deux reprises. Chez les mammifères, les récepteurs olfactifs sont des récepteurs couplés aux protéines G (récepteurs métabotropiques), tandis que chez les insectes, les récepteurs olfactifs sont des canaux ioniques (récepteurs ionotropiques). Un canal ionique ne permet pas une amplification du signal comme dans le cas des récepteurs couplés aux protéines G. Cependant, le message est direct, par le changement de concentration des ions à la surface du neurone olfactif d'insecte. Les insectes préfèrent la rapidité à la sensibilité, est-ce une question de taille des organismes d'insectes par rapport à ceux des mamifère ?
Merci pour votre lecture.
Mes autres billets de blog :
1. La tête dans un site actif : Le LSD couplé à son récepteur 5HT2B
2. Prédire la cardiotoxicité d'un RC ? RdR par l'IA
3. Liaisons chimiques : A. Liaisons covalentes (MAO-A et rhodopsine)
4. Liaisons chimiques : B. Liaisons non covalentes (LSD/5HT2B)
5. Nicotine, cancer et addiction. Molécule du mois sur la PDB

- Morning Glory
Holofractale de l'Hypervérité - 16 juin 2022 à 21:00
GTP, GDB, PIB?
Que font les metabotropiques par rapport aux ionotropiques mise à part l'amplification du signal? La cascade de réactions en chaîne intracellulaire ne modifie-t-elle pas le métabolisme de la cellule, ou quelque chose de plus durable en tout cas, que juste passer un simple signal à une autre cellule un peu plus loin? Tu vois ce que je veux dire? Il doit bien y avoir des répercussions sur la cellule.
Quand tu dis que les GPCRs sont "attaqués", le prozac et autres drogues ne l'abiment pas hein? Il peut être éventuellement downrégulé par tolérance, mais on est d'accord que les drogues ne l'abiment pas directement au contraire de la toxine dont tu as parlé ensuite?
Arigato!

Tu connais surement de nom l'ATP et peut être l'ADP. L'ATP c'est une molécule extrêmement importante dans notre corps qui est un peu la monnaie d'échange énergétique de base des organismes vivants au niveau des cellules.
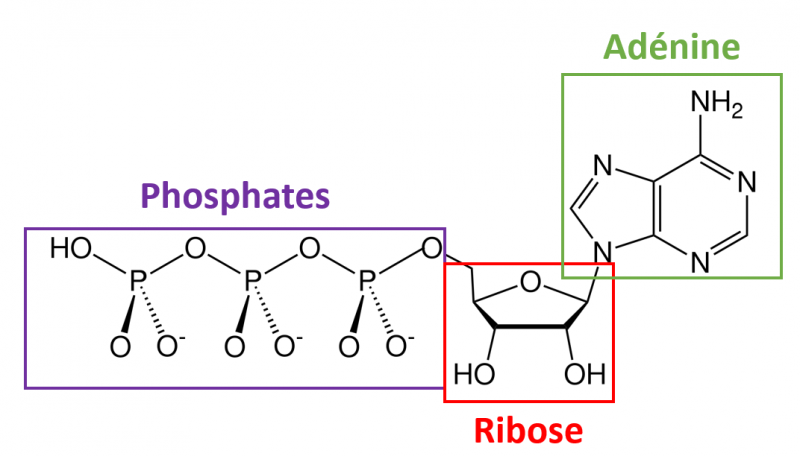
ATP ça veut dire adénosine triphosphate. C'est donc comme le nom l'indique une molécule d'adénosine (composé d'un sucre, le ribose, avec une molécule d'adénine) additionnée de 3 groupements phosphates. Lorsque le corps vire le premier phosphate des 3 phosphates, ça donne de l'ADP (avec le D pour di ou 2 phosphates) et surtout ça libère de l'énergie.
Le groupement phosphate qui est libéré, peut être fixé à une protéine, sur un acide aminé sérine par exemple. Phosphoryler une protéine peut servir de marqueur pour déclencher une certaine réaction. Dans le cas des GPCRs, lorsque le neurone est trop actif et qu'il faut baisser son activité, le premier réflexe de la cellule est d'internaliser le récepteur pour l'inactiver. Le premier pas dans ce mécanisme, c'est de mettre un groupement phosphate au niveau ou la protéine G se lie au récepteur.
L'ATP peut aussi être transformé en AMPc pour AMP cylique, un ATP ou l'on a viré les 2 premiers phosphates et dont la structure a été cyclisée. C'est un des principaux seconds messagers.
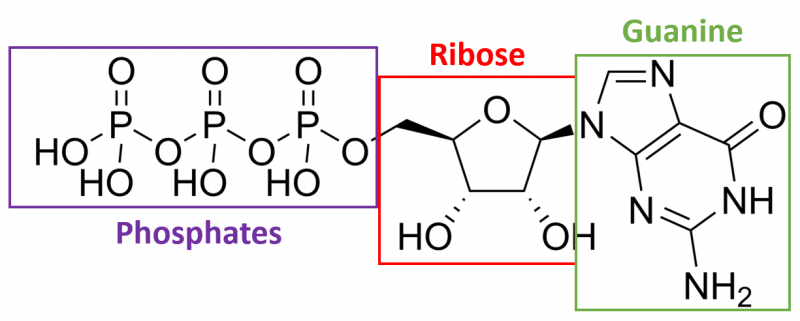
En parallèle à ça, il existe aussi le GTP et le GDP. Même combat, sauf que ce coup-ci, au lieu d'avoir une molécule d'adénosine, on a une molécule de guanine légèrement différente.
Donc les molécules de GTP, d'ATP et consorts, ce sont un peu des molécules à tout faire des cellules : Stockage et libération de l'énergie, marqueur en donnant leurs groupements phosphates, messagers chimiques.
PIB
Ça, c'est le produit intérieur brut, mais ça sort totalement de mon domaine d'expertise haha, tu voulais dire autre chose ?
Que font les metabotropiques par rapport aux ionotropiques mise à part l'amplification du signal? La cascade de réactions en chaîne intracellulaire ne modifie-t-elle pas le métabolisme de la cellule, ou quelque chose de plus durable en tout cas, que juste passer un simple signal à une autre cellule un peu plus loin? Tu vois ce que je veux dire? Il doit bien y avoir des répercussions sur la cellule.
En fait, ces 2 types de récepteurs ont la même fonction : Transmettre de l'information de l'extérieur à l'intérieur de la cellule. On a une grande quantité de récepteurs différents, chacun reconnaissant un message particulier (qui peut être chimique, mais aussi mécanique ou même lumineux). Ces 2 types de récepteurs ont le potentiel de modifier le métabolisme de la cellule, suivant le message qui est transmis. Dans le cas des neurones, le message des neurotransmetteurs a pour vocation d'être transmis à un autre, mais cela provoque aussi des changements à l'intérieur de la cellule. Il y a réception du message et transmission, mais aussi traitement du message. Le message est trop fort ? Le neurone le transmet, mais baisse sa production de récepteurs, ce qui crée une tolérance.
Quand tu dis que les GPCRs sont "attaqués", le prozac et autres drogues ne l'abiment pas hein? Il peut être éventuellement downrégulé par tolérance, mais on est d'accord que les drogues ne l'abiment pas directement au contraire de la toxine dont tu as parlé ensuite?
Oui c'est exactement ça. Et même la toxine "n'abime" pas le récepteur. La protéine G se retrouve activée en permanance, la voie de signalisation est activée sans arrêt, ce qui plante totalement le passage de l'information et in fine peut tuer le neurone. Après il existe pleins de toxines différentes. Certaines sont bien plus basiques dans leur action que cibler un certain chainon de la transmission synaptique. Par exemple, je crois que le venin d'abeille ou de guêpe, ce sont tout simplement des petites protéines, qui lorsqu'elles arrivent sur la membrane d'une cellule, vont s'associer pour former des espèces de tonneaux. Ça créé des trous, le milieu intérieur n'est plus contrôlé et ça explose la cellule. Simple et efficace haha.

- Morning Glory
Holofractale de l'Hypervérité - 20 juin 2022 à 20:01
Alors c'est quoi la différence d'un point de vue fonctionnel entre la GTP et l'ATP par exemple? J'imagine que l'une ne se substitue pas à l'autre, quelle différence, quel est leur rôle respectif?
"PIB," Ça, c'est le produit intérieur brut, mais ça sort totalement de mon domaine d'expertise haha, tu voulais dire autre chose ?
C'est toi qui l'a utilisé, ici: huhu. Faute de frappe?
= Cela amène la protéine G à expulser sa molécule de PIB et à la remplacer par du GTP.
-----
Le message est trop fort ? Le neurone le transmet, mais baisse sa production de récepteurs, ce qui crée une tolérance.
Je passe un peu en hors sujet mais, tu sais toi pourquoi le neurone préfère s'autodétruire en cas d'hyperexcitabilité plutôt que simplement se mettre en veille? J'y trouve pas très adaptatif cette apoptose. Je me suis souvent posé la question. Pourquoi cette autodestruction en cas de sur-excitation, d'accord ça peut éventuellement éviter que TOUT l'organisme finisse en surexcitation maiiiis une mise en veille des récepteurs dudit neurone aurait été plus mieux bien, moins de dégâts quoi. Tu vois?
Alors je me suis dit que peut-être la "mise en veille" (tolérance en quelque sorte) était peut-être trop peu réactive, trop lente à se mettre en place comparé à l'urgence d'une hyperexcitabilité, mais ce n'est qu'hypothèse, le mystère me fait toujours vibrer (et un peu virer lorsque j'abuse des drogues^^').

- Mychkine
Artichaut dans une caisse d'oranges - 21 juin 2022 à 13:24
Morning Glory a écrit
pourquoi le neurone préfère s'autodétruire en cas d'hyperexcitabilité plutôt que simplement se mettre en veille? J'y trouve pas très adaptatif cette apoptose.
https://en.wikipedia.org/wiki/Excitotoxicity
D'après ce que je vois, l'excitotoxicité est médiée par l'excès de calcium intracellulaire, qui initie un processus de dérégulation multifactoriel dont l'apoptose n'est que le phénomène terminal, réaction physiologique ultime traduisant simplement l'incapacité du corps à y faire face. Le fait que les neurones sont finalement assez peu exposés à l'excès de neurotransmetteurs excitateurs dans la nature (les chocs traumatiques, souvent de toutes façons mortels ou incapacitants, en étant à ma connaissance à peu près la seule cause relativement commune) expliquerait, à mon sens, que l'évolution ne nous ait pas donné les capacités d'y faire pleinement façe.*+ Il est également possible que les mécanismes physiologiques impactés par une blessure crânienne soient trop nombreux, subtils, complexes et imbriqués pour que le corps puisse y opposer une réponse efficace, en dépit de centaines de millions d'années de sélection.
L'événement prend acte à plusieurs niveaux :
-enzymatique (suractivation de protéases, endonucléases et phospholipidases qui vont dégrader l'ADN, la membrane, etc. Pour moi ce phénomène ne peut que résulter d'un dysfonctionnement par excès d'un processus normalement physiologique. Mais je n'ai pas de formation médicale, donc avis à prendre avec des pincettes.)
-mitochondriale** (expression d'un facteur de perméabilité membranaire (MPTP) qui va autoriser un influx plus important de Ca++ dans la mitochondrie ->production de radicaux libres (Reactive Oxygen Species) ->destruction de la mitochondrie ->encore plus de Ca++ cytosolique, perturbation de la production d'ATP donc des fonctions cellulaires (notamment l'arrêt de la recapture des neurotransmetteurs excitateurs voire l'inversion des transporteurs par perte du gradient d'ions chez les astrocytes et les neurones glutamatergiques : https://pubmed.ncbi.nlm.nih.gov/11720790/). Ce phénomène, et notamment l'existence du MPTP, a une fonction évolutive encore mal comprise, mais elle existe probablement car elle est commune à la quasi-totalité des eucaryotes. Une hypothèse est qu'elle permettrait une auto-destruction sélective des mitochondries les plus disposées à la production de ROS en cas de stress nutritif. (https://en.wikipedia.org/wiki/Mitochond … y_purpose))
-extraneuronale (les ROS émises par les mitochondries déclenchent une diminution de l'activité des transporteurs du glutamate EAAT2 présents sur les cellules gliales***, ce qui augmente encore la concentration intrasynaptique de glutamate. Je ne sais pas si un tel mécanisme est le résultat d'un processus de sélection, auquel cas il aurait un intérêt évolutif, ou si il relève d'un dysfonctionnement du système glutamatergique. Peut-être que les ROS dégradent directement les EAAT2 ou constituent une menace pour les cellules gliales, qui se voient alors contraintes de réduire leur activité. (Accessoirement, je signale n'avoir pas vu clairement si les ROS impliqués provenaient des neurones post-synaptiques, des cellules gliales elles-mêmes (il faudrait alors qu'elles soient elles aussi prédisposées à l'excitotoxicité via des récepteurs idoines) ou les deux.))
La combinaison de ces effets mène, par un jeu de rétroaction positive et la dégradation exponentielle de la cellule, à une accumulation de dommages qui la rend in fine dysfonctionnelle, voire néfastes pour les cellules en aval. L'apoptose permet donc, comme c'est souvent le cas dans ces moments, de mettre fin à un phénomène également dangereux pour l'organisme dans son ensemble (e.g. les dommages à l'ADN, cause potentielle de cancer).
Bon, je vais arrêter là, à cause de tout ça j'ai oublié de manger 
*Notons toutefois que l'administration de dissociatifs antagonistes NMDA (tels que la kétamine) peut, en bloquant les récepteurs NMDA extracellulaires, dans une certaine mesure atténuer la réponse excitotoxique du neurone en cas de choc ischémique (https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6051917/ , https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7788834/ )
+La cause de la mort dans les sociétés paléolithique étant le plus souvent traumatique, mais pas nécessairement cérébrale (famine, accouchement, infections...). Je ne retrouve plus la source malheureusement.
**TIens, bah en parlant de mitochondries, je viens de trouver cet article (pas encore lu) reliant dépression et dysfonction mitochondriale. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5997778/
***Additionnellement, et de façon un brin digressive, j'ai appris que l'expression des tranporteurs EAAT2 est réduite de façon persistante par l'usage chronique de drogues addictogènes (cocaine, alcool, etc.) dans le noyau accubens. (https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4009342/ , section 3). Ceci constitue un exemple supplémentaire de l'altération des processus neuronaux induite par l'addiction.
C'est toi qui l'a utilisé, ici: huhu. Faute de frappe?
Hahahah effectivement rien à voir ! Je voulais parler de GDP. Lorsque la protéine G est sous forme inactive, elle est liée au GDP. Et lorsqu'elle s'active, elle remplace sa molécule de GDP par une molécule de GTP.
Alors c'est quoi la différence d'un point de vue fonctionnel entre la GTP et l'ATP par exemple? J'imagine que l'une ne se substitue pas à l'autre, quelle différence, quel est leur rôle respectif?
C'est une question très intéressante à laquelle je n'ai qu'une réponse partielle. Les 2 molécules permettent d'apporter de l'énergie et sont impliquées dans différentes réactions. Le corps semble avoir besoin de plusieurs flaveurs de ce type de molécule. Surement pour permettre un contrôle plus fin des réactions ou sont impliquées ces 2 molécules (imagine un piano à une touche, ou un piano à 2 touches). Pour répondre correctement à cette question, il faudrait regarder l'évolution du métabolisme à travers les différentes espèces. Quand est-ce que l'utilisation conjointe du GTP et de l'ATP est apparue ? Quand est-ce que l'utilisation du GTP est apparue ? Et celle de l'ATP ? A quel moment (et quel niveau de complexité de l'organisme) il y a eu besoin de l'utilisation conjointe de ces 2 molécules ? Je n'ai pas la réponse à cette question, mais elle est excellente et j'aimerais avoir la réponse :)
Je passe un peu en hors sujet mais, tu sais toi pourquoi le neurone préfère s'autodétruire en cas d'hyperexcitabilité plutôt que simplement se mettre en veille? J'y trouve pas très adaptatif cette apoptose. Je me suis souvent posé la question. Pourquoi cette autodestruction en cas de sur-excitation, d'accord ça peut éventuellement éviter que TOUT l'organisme finisse en surexcitation maiiiis une mise en veille des récepteurs dudit neurone aurait été plus mieux bien, moins de dégâts quoi. Tu vois?
Alors je me suis dit que peut-être la "mise en veille" (tolérance en quelque sorte) était peut-être trop peu réactive, trop lente à se mettre en place comparé à l'urgence d'une hyperexcitabilité, mais ce n'est qu'hypothèse, le mystère me fait toujours vibrer (et un peu virer lorsque j'abuse des drogues^^').
Déjà merci pour la réponse myskine. J'ajoute un complément de réponse : En fait, lorsqu'une cellule est en difficulté et face à un stress trop intense, il y a plusieurs réponses possibles. L'apoptose, c'est la mort "contrôlée", programmée, d'une cellule. La cellule décide elle-même de se supprimer pour le bien de l'organisme, et se prépare à le faire de façon la plus clean possible. Si le stress est encore plus important, il peut tout simplement y avoir lyse cellulaire (ou nécrose). La cellule éclate totalement, et c'est encore pire pour les cellules adjacentes, ça provoque une forte inflammation étant donné que tout le contenu de la cellule est déversé dans l'environnement sans aucune préparation. Donc l'apoptose, il faut le voir comme un moindre mal dans une situation de crise cellulaire.
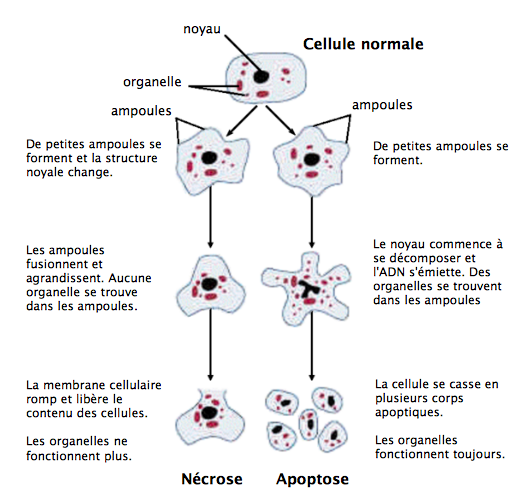
Affichage Bureau - A propos de Psychoactif - Politique de confidentialité - CGU - Contact -
 Soutenez PsychoACTIF
Soutenez PsychoACTIF